Entrepreneuriat & Stratégie
Réglementation cosmétique Europe, US et GCC : points communs et différences ?
Quel sont les points communs et les différences entre les réglementations cosmétiques en Europe, aux US et dans les Pays du Golfe ?
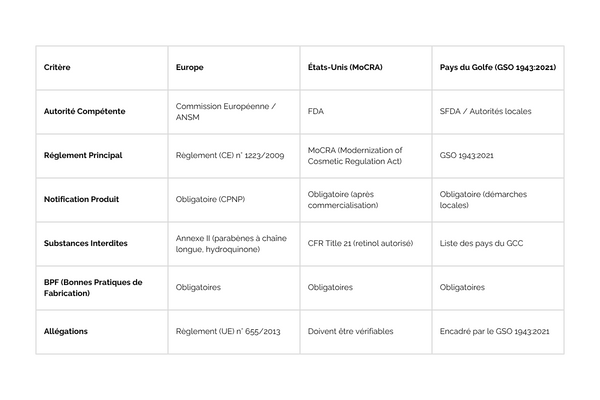
Règlement Européen 1223/2009, MoCRA, GSO 1943:2021
Une marque qui se lance en 2025 doit tenir compte de la réglementation cosmétique internationale. Connaître les spécificités réglementaires de chaque régions permet d’anticiper, dès la phase de développement, une future expansion internationale. Tour d’horizon des points communs et des spécificités des réglementation cosmétiques en Europe, aux US et dans les pays du Golfe.
La réglementation cosmétique Européenne - Réglement 1223/2009
Réglementation cosmétique européenne : notion de Personne Responsable et DIP
En Europe, la réglementation des produits cosmétiques repose sur le Règlement (CE) n° 1223/2009, qui exige que chaque produit mis sur le marché soit accompagné d’un Dossier d’Information Produit (DIP). Le DIP comprend toutes les informations nécessaires pour garantir la sécurité et la conformité des produits. Un élément essentiel du règlement européen est la notion de « personne responsable » (PR), qui est une entité juridique responsable de la mise sur le marché du produit cosmétique et de sa conformité avec la législation européenne.
Qui est la Personne Responsable (PR) ?
La personne responsable est celle qui veille à la conformité des produits cosmétiques avant leur commercialisation. Selon le Règlement 1223/2009 :
-
Fabricant : Si le fabricant est situé dans l’Union Européenne, il est responsable de la mise sur le marché du produit cosmétique.
-
Importateur : Si le fabricant est situé hors de l’UE, l’importateur devient la personne responsable en Europe.
-
Distributeur : Le distributeur peut également être désigné comme la personne responsable si le fabricant ou l’importateur ne prend pas cette responsabilité. Dans le cas où le fabricant est un sous-traitant d’une marque, le donneur d’ordre (la marque) est la personne responsable.
En Europe, la personne responsable doit inscrire le produit sur le Cosmetic Product Notification Portal (CPNP) avant de le mettre sur le marché.
Contenu du Dossier d’Information Produit (DIP) en Europe :
Le DIP doit contenir les informations suivantes :
-
Formulation complète du produit, y compris la liste des ingrédients et informations sur les matières premières.
-
Rapport d’évaluation de la sécurité du produit fini (incluant des tests de stabilité, challenge test microbiologique, et évaluation de la tolérance cutanée).
-
Dossier de fabrication avec les bonnes pratiques de fabrication (BPF), notamment la conformité avec la norme ISO 22716.
-
Étiquetage et allégations sur le produit, qui doivent être justifiés par des preuves scientifiques. (découvrez le détail des obligations en matière d’étiquetage pour le marché européen)
-
Rapport sur les tests effectués pour garantir la sécurité du produit (tests de stabilité, tests microbiologiques, etc.).
Le Dossier d’Information Produit est essentiel pour garantir que le produit est conforme aux normes européennes et qu’il peut être mis sur le marché en toute sécurité.
Identification de la Personne Responsable (PR) sur le Packaging en Europe :
En Europe, la personne responsable doit être clairement identifiée sur le packaging des produits cosmétiques. Le nom et l’adresse de la personne responsable doivent être indiqués de manière lisible et visible sur l’emballage ou l’étiquette du produit. Cela permet aux consommateurs, aux autorités sanitaires et aux autres parties prenantes de savoir qui est responsable de la sécurité et de la conformité du produit.
Réglementation cosmétique aux États-Unis : MoCRA et ses changements
Aux États-Unis, la Federal Food, Drug, and Cosmetic Act (FDCA) régit la sécurité des produits cosmétiques, mais la récente Modernization of Cosmetic Regulation Act (MoCRA), entrée en vigueur en 2022, a renforcé les exigences, notamment en matière de notification, de BPF et de sécurité des produits.
Qui est la Personne Responsable (PR) aux États-Unis ?
Sous MoCRA, la personne responsable peut être le fabricant ou le distributeur des produits cosmétiques. Cette personne est responsable de la mise sur le marché et de la conformité des produits. Selon MoCRA, la personne responsable doit notifier les produits à la FDA dans les 60 jours suivant leur commercialisation. Le certificat de sécurité demandé dans le cadre de MoCRA est similaire à l’évaluation de la sécurité en Europe, bien qu’il ne soit pas aussi détaillé en termes de toxicologie.
Le Dossier de notification FDA comprend les éléments suivants :
-
Nom et adresse de l’entreprise (Personne Responsable)
-
Liste des ingrédients avec leurs concentrations.
-
Description du produit et de son usage prévu.
- Conformité aux BPF
-
Certificat de sécurité, confirmant que le produit respecte les normes de sécurité, y compris les évaluations des risques et des tests de stabilité.
-
Étiquetage, conforme aux exigences de la FDA, incluant les allégations (qui doivent être vérifiables).
Identification de la Personne Responsable (PR) sur le Packaging aux États-Unis :
Aux États-Unis, MoCRA impose également que l’identité de la personne responsable (nom et adresse de l’entreprise) soit clairement indiquée sur le packaging des produits cosmétiques. Cela permet de garantir que, en cas de problème, les autorités puissent rapidement contacter la personne responsable pour résoudre la situation.
Réglementation cosmétique des pays du Golfe (GCC) : GSO 1943:2021 et enregistrements locaux
Le Conseil de Coopération du Golfe (GCC), qui comprend l’Arabie Saoudite, les Émirats Arabes Unis, le Koweït, le Bahreïn, le Qatar et Oman, utilise un cadre réglementaire commun, défini par le Gulf Standard GSO 1943:2021, qui encadre la sécurité, la qualité et l’étiquetage des produits cosmétiques. Toutefois, chaque pays impose des enregistrements locaux des produits.
Qui est la Personne Responsable (PR) dans les pays du GCC ?
La personne responsable dans les pays du GCC peut être le fabricant ou l’importateur des produits cosmétiques. Comme en Europe, l’entité responsable doit s’assurer que le produit est conforme aux normes locales et soumettre les produits à l’enregistrement auprès des autorités compétentes dans chaque pays.
Le DIP dans les pays du GCC comprend des éléments similaires à ceux en Europe :
-
Liste des ingrédients et concentrations conformes aux normes locales.
-
Certificat de sécurité, incluant des tests de stabilité, tests microbiologiques, et une évaluation de la sécurité réalisée par un toxicologue qualifié.
-
Certificat de Bonnes Pratiques de Fabrication (BPF), souvent conforme à la norme ISO 22716.
-
Étiquetage conforme aux exigences locales, qui peuvent inclure des informations en arabe.
Démarches d’Enregistrement Local dans les pays du GCC :
Dans chaque pays du GCC, l’enregistrement des produits est nécessaire avant la mise sur le marché, et les démarches peuvent différer légèrement d’un pays à l’autre. En Arabie Saoudite, les produits doivent être enregistrés auprès de la Saudi Food and Drug Authority (SFDA), tandis qu’aux Émirats Arabes Unis, l’enregistrement se fait auprès du Ministère de la Santé ou des autorités locales comme la Dubai Municipality.
Les points communs des différentes réglementations cosmétiques
- Les Bonnes Pratiques de Fabrication (BPF) : Exigées dans toutes les régions (ISO 22716).
-
Identification de la Personne Responsable sur le Packaging
-
Évaluation de la sécurité des produits finis : Les tests se concentrent sur le produit fini et non sur les ingrédients individuels. Cela inclut les tests de stabilité, de tolérance et de microbiologie.
-
Substances interdites : Chaque région a une liste de substances interdites et restreintes, même si ces listes varient légèrement. L’hydroquinone et certains parabènes à chaîne longue sont interdits dans les trois régions.
Les différences entre les réglementations cosmétiques
-
Notification préalable des produits :
-
En Europe, la notification via le CPNP est obligatoire avant la mise sur le marché.
-
Aux États-Unis, la notification à la FDA devient obligatoire après la mise sur le marché avec MoCRA.
-
Dans les pays du GCC, l’enregistrement local est requis avant la mise sur le marché, mais chaque pays a des procédures spécifiques.
-
-
Substances interdites et limitées :
-
En Europe, les Annexes II et III du règlement 1223/2009 détaillent les substances interdites et limitées. La hydroquinone et les parabènes à chaîne longue sont des exemples.
-
Aux États-Unis, le CFR Title 21 liste les substances interdites, mais il y a moins de restrictions spécifiques que celles appliquées en Europe. Le retinol est autorisé sous des conditions spécifiques.
-
Les pays du GCC suivent le GSO 1943:2021, mais les listes d’ingrédients interdits peuvent varier légèrement d’un pays à l’autre.
-
Entrepreneur, responsable produit, professionnel de la beauté ? Inscrivez-vous pour recevoir nos veilles techniques et inspirations.
Conclusion
Les réglementations des pays du Golfe et des États-Unis s’inspirent largement de la réglementation européenne, ce qui offre un avantage considérable aux entreprises de l’Union Européenne, déjà bien familiarisées avec ces exigences depuis l’entrée en vigueur du Règlement (CE) n° 1223/2009 en 2009. En raison de cette similitude, les entreprises européennes ont un atout important pour naviguer plus aisément dans les exigences de sécurité des produits, de notification et de contrôle des allégations, facilitant ainsi leur expansion sur les marchés internationaux tout en minimisant les ajustements nécessaires pour se conformer aux réglementations locales. Si vous avez besoin d’accompagnement, contactez nous ici.
Nos derniers articles
Dr Lucile Battail Ghanem décrypte les tendances de la French Pharmacy.
Le blog - TFPEREPERES
Points communs et différences entre les réglementations cosmétiques dans le monde